
Hva er ditt forskningsfelt, og hva er hovedmålene for forskningsgruppen din?
Vi ønsker å finne ut hvordan kromatin organiseres i cellene. Vi er spesielt interesserte i å finne ut mer om kromatinorganisering på sentromerer, området på kromosomer som har som oppgave å fordele kromosomene nøyaktig når cellene deler seg.
Hvilke prosjekter jobber du med for øyeblikket, og hva ønsker du å avdekke?
For tiden prøver vi å forstå hvordan kromatin på sentromerer er forskjellig fra resten av kromosomet.
Sentromeren på kromosomet spiller en veldig viktig rolle under celledelingen, og er ankerpunktet for mikrotubuli som trekker kondenserte, dupliserte kromosomer for å distribuere dem likt inn i to nye datterceller. Hvert kromosom trenger bare én og bare én funksjonell sentromer for å kunne overføres til begge dattercellene under celledeling. Hvis så ikke skjer, kan celledelingen mislykkes og potensielt føre til sykdom, f.eks. kreft.

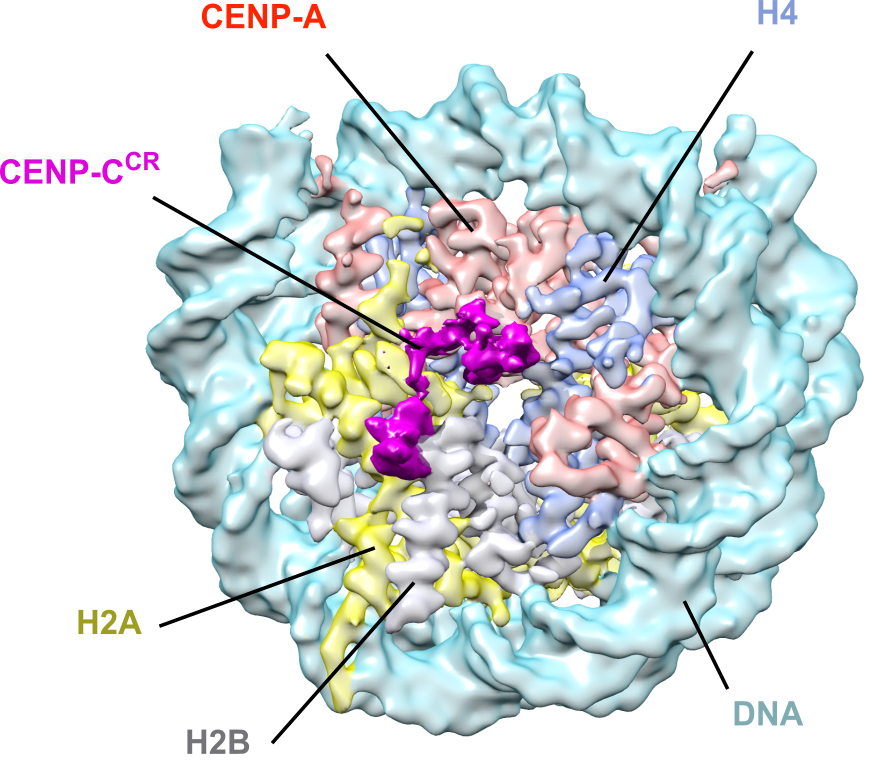
Kromosomer er bygget opp av kromatin, komplekse DNA-proteinstrukturer med nukleosomer som byggeenhet. Nukleosomer er kuleformede strukturer sammensatt av DNA, og tvunnet rundt en kjerne av proteiner som heter histoner. Vi fokuserer arbeidet vårt på en spesiell type histoner kalt CENP-A, som bare eksisterer i sentromerer. Dette histonet er nødvendig og tilstrekkelig for korrekt formasjon og opprettholdelse av en funksjonell sentromer. Vi ønsker å forstå hvordan nukleosomer som inneholder CENP-A lager kromatinstrukturen i sentromer og tiltrekker seg andre sentromer-proteiner. Vi har brukt kryo-elektronmikroskopi (cryo-EM) for å definere den høyoppløselige molekylære strukturen i CENP-A-nukleosomer, og har fått innsikt i de viktige molekylære hendelsene som styrer celledeling.
Nå utvider vi forskningen vår for å få et mer helhetlig bilde av den molekylære organiseringen i sentromerer. Vi har derfor startet et samarbeid med Halic lab ved St. Jude’s Hospital i USA, og med vårt nordiske søsterinstitutt MIMS (Nordic EMBL Partnership) i Umeå, Sverige.
Forskningsgruppen din har anskaffet et instrument som muliggjør hydrogen-deuterium utveksling koblet til massespektrometri (HDX-MS). Kan du fortelle oss mer om dette instrumentet og hvordan det kan hjelpe dere med å nå forskningsmålene deres?
Det stemmer at vi nå har fått installert en topp moderne HDX-MS-plattform i laboratoriet vårt! Dette er det første og eneste apparatet med HDX-kapasitet i Norge og er nå tilgjengelig også for nasjonale samarbeidsprosjekter.

Måling av hydrogen-deuterium utveksling (HDX) er en kraftig virkende teknikk som gir kunnskap om proteindynamikk. Teknikken er basert på egenskapen til hydrogen i proteinpeptider som byttes ut med hydrogen (eller deuterium) fra et løsning, innenfor en tidsramme på sekunder eller timer (noen ganger også dager). Denne utvekslingen skjer raskere i områder av proteinet som er eksponert mot løsningen og går langsommere i de områdene der proteinryggraden er engasjert i hydrogenforbindelser (f.eks. danning av sekundærstrukturer i proteinet) eller til en ligand (bindinger til andre proteiner, medikamenter, lipider osv.).
I vårt system måles omfanget av «deuterasjon» og eksponering mot løsningen med et avansert massespektrometer, som også har elektronoverføring og dissosiasjon (ETD) og kapasitet for ionmobilitet for økt oppløsning. HDX bidrar med strukturell og dynamisk informasjon og er derfor en svært nyttig metode i forskning innen strukturell biologi. Data kan genereres ved å bruke kun en liten proteinmengde, og tilnærmingsmåten kan fange opp nesten alle typer strukturendringer i proteiner som befinner seg i en løsninger. Det finnes veldig mange bruksområder innen forskning og legemiddelindustri, som forskning på proteindynamikk i forskjellige løsemidler, overvåking av proteinfolding samt identifisering av strukturelle endringer ved binding av en ligand og som et resultat av post-translasjonelle modifikasjoner.

En av de mest interessante bruksområdet for HDX er å undersøke effekten av interaksjoner mellom legemidler og proteiner. Forskjeller i HDX kan her identifisere områder på proteinet som medikamentet binder til eller medikamentets effekt på samlet stabilitet/dynamikk i proteinet. Dette kan på sikt bidra til utvikling av nye legemidler.
Laboratoriet vårt bruker nå HDX til å undersøke effekten av (auto)fosforylering på et bestemt mitotisk proteinkinasekompleks, som også er et medikamentmål. Vi har oppdaget at fosforyleringen gjør enzymkomplekset mer rigid, og vi har en hypotese om at den rigiditeten er nødvendig for kinaseaktivitet. Videre ønsker vi å undersøke hvordan fosforylering på et sted som er langt fra det aktive området kan påvirke enzymaktivitet.
Dette kan gi oss muligheter til å lage såkalte allosteriske medikamenter, som kan bidra til mer spesifikk og nøyaktig medisinering.
Hva motiverer deg i forskningen?
For det meste ren nysgjerrighet. Jeg liker å forstå tingene som er rundt meg.
Jeg synes den meget nøyaktige celledelingen er veldig spennende. Den er så fundamental at den er som en definisjon av selve livet. Duplisering og selvformering er forutsetninger for den levende verdenen slik vi kjenner den, og det er helt avgjørende at denne prosessen er nøyaktig og treffsikker. Fenomener som omkoding, lagring, formering og bruk av genetisk informasjon er fremdeles veldig fascinerende og lite utforsket.
Jeg er overbevist om at det å forstå slike fundamentale biologiske prosesser har et enormt potensial innen utviklingen av nye teknologier og behandlingsformer (CRISPR-Cas9 og styrt evolusjon er bare to nyere eksempler). Og det er selvsagt svært motiverende å vite at min nysgjerrighet kan komme menneskeheten til gode.
Hva har vært de største gjennombruddene innen ditt forskningsfelt de siste ti årene?
I flere tiår trodde vi at sentromeren var genetisk definert, gjennom posisjonen til spesielt repeterende AT-rikt DNA. Denne oppfatningen endret seg i 1997, da Andy Choo (University of Melbourne, Australia) beskrev den menneskelige neosentromeren (en funksjonell sentromer på et nytt område på kromosomet, uten spesifikt DNA) hos en av pasientene sine.
Dette satte i gang en mengde forskning og identifiserte histon CENP-A som en epigenetisk markør for sentromerer. Idéen om at en så viktig del av kromosomet er kodet epigenetisk (dvs. gjennom proteinet CENP-A) og ikke genetisk (gjennom DNA) fascinerer meg. Som forskningsmiljø forsøker vi fremdeles å forstå samhandlingen mellom genetiske og epigenetiske elementer når det gjelder å definere og vedlikeholde sentromeren.
Hvor tror du ditt forskningsfelt vil være om ti år?
Utviklingen av nye kraftfulle teknikker som CRISPR-Cas9, CryoEM og mikroskopi med superoppløsning fremmer generelt vitenskapen i et høyt tempo. På områdene genetikk og epigenetikk forventer jeg at vi vil finne ut mer om prinsippene for kromatinfolding i cellekjernen. Dette vil hjelpe oss til å forstå hvordan genetisk informasjon kan gjøres tilgjengelig ved transkripsjonfaktorer eller gjennom DNA-reparasjon, og hvordan kromatin genererer strukturer med spesifikke funksjoner, som sentromeren.
Jeg tror det vil bli mulig å bruke denne kunnskapen i syntetisk kjemi og lage nye kunstige kromosomer med kontrollerte funksjoner, som kan føre til bedre behandlingsformer for mange sykdommer og forbedringer innen jordbruk og bioteknologi.
Fortell oss litt om hva du gjorde før du kom til NCMM
Jeg vokste opp i Zagreb i Kroatia, og flyttet deretter til Beograd i Serbia for å ta en bachelor i biokjemi. Etter det bodde jeg i USA i 15 år. Under doktorgradsstudiene ved University of Illinois i Chicago lærte jeg mye om proteinkjemi og røntgenkrystallografi gjennom å studere kinaser i små biomolekyler.
Da jeg ble postdoktor, fant jeg ut at jeg ville lære mer om komplekse molekylære prosesser og arbeide med store proteinkomplekser. Jeg har alltid vært interessert i DNA og genetikk, og derfor søkte jeg meg til laboratoriet ledet av professor Ben Black ved University of Pennsylvania. Det var der jeg ble skikkelig begeistret for kromatin og sentromerer.
Hva har vært det største øyeblikket i karrieren din så langt?
Muligheten til å starte mitt eget laboratorium her ved UiO. Det å ha frihet og ressurser til å jobbe med egen forskning er fantastisk, og det er mange begavede og lovende forskere som aldri får denne muligheten. Det er selvfølgelig også mange utfordringer knyttet til å drive sitt eget laboratorium. Jeg er takknemlig overfor NCMM som har hjulpet meg i overgangsfasen gjennom et støttende forskningsmiljø.
Hva ville du drevet med hvis du ikke hadde arbeidet innen forskning?

Jeg har alltid ønsket å forstå ting rundt meg, derfor var vitenskap/realfag det naturlige valget. Biokjemi var spesielt interessant fordi det handlet om å få innblikk i molekylene i levende materie. Og hvor fantastisk er ikke det!
Jeg tenkte ikke så mye på karrieren. Jeg ville bare lære mer. Alle som jobber innen forskning og vitenskap vet at ting ikke alltid går som planlagt, at det er mange oppturer og nedturer og at resultatene ofte uteblir selv etter veldig hardt arbeid. Under doktorgradsstudiene gikk jeg til yrkesveiledning, og da fant jeg ut at jeg passet til å bli lærer, sosialarbeider, lege eller programmerer. Jeg ble skuffet og tenkte at yrkestesten ikke hadde virket slik jeg ville.
Over tid har jeg imidlertid innsett at testen traff bedre enn jeg klarte å forstå den gangen. Jeg liker trekke logiske slutninger mellom fakta, jeg liker å gjøre ting som kan være til nytte for samfunnet og hvis du legger en anelse kreativitet til det hele, så er det perfekt. Mange ulike karriereveier kan passe, men jeg føler at min nåværende jobb har den perfekte sammensetningen av ting jeg liker å gjøre. Jeg trives godt med å være der jeg er.
Fortell oss om noe om deg selv som du tror kan overraske kollegene dine
Familien min er flerspråklig. Hver dag kommuniserer vi på fire forskjellige språk (kroatisk/serbisk, spansk, engelsk og norsk). Det gjør vel de to barna våre, som snakker alle språkene flytende, «firespråklige»!