Alle cellene i kroppen har samme DNA, men likevel er de forskjellige. Dette får cellene til ved å regulere hvilke gener de tar i bruk og hvilke de lar ligge.
Reversible endringer
Epigenetikken skrur av noen gener og på andre gener og sørger celler i kroppen vår får forskjellige egenskaper. Noen blir til hudceller, noen muskelceller, andre nerveceller. Ettersom cellene deler seg og blir mer spesialiserte følger dette mønsteret med, og dattercellene arver de samme egenskapene.
Men hvilke gener som er i bruk påvirkes ikke bare av spesialisering mot en celletype. Vi kan og skru av og på gener for å tilpasse oss forandringer i miljøet rundt oss. Livsstilsfaktorer som stress, trening, kosthold, røyking og medikamentbruk, påvirker også hvilke gener som brukes.
Epigenetikk er læren om disse endringene i genaktiviteten. Rekkefølgen i DNA-sekvensen endres ikke, men det gjøres andre endringer, epigenetiske endringer, som på et hvert tidspunkt avgjør om genet skal tas i bruk eller ikke. De epigenetiske forandringene er reversible.

50-50 arv og epigenetikk
Ragnhild Eskeland, nyansatt på IMB, har forsket på epigenetikk hele sin karriere.
Hun trekker frem eneggede tvillinger som et eksempel på hvor epigenetiske forskjeller synes. – Det er forskjell på de eneggede tvillingene, sier hun, – selv om de har nøyaktig samme DNA. Dette skyldes blant annet miljøforskjeller som de blir utsatt for gjennom livet, som kan føre til forskjellig bruk av noen av genene. Vi antar disse forskjellene skyldes sånn cirka 50 % arv og 50 % miljø eller epigenetikk, forteller Eskeland.
Epigenetikk og kreft
Epigenetiske mekanismer bidrar til at cellene oppfører seg som de skal, men feil kan skje. Celler som blir til kreftceller gjennomgår mange forandringer, og det oppstår feil i det intrikate samspillet mellom genetiske faktorer og miljø.
Her er epigenetikken sentral. Et kjennetegn for kreftceller er at det epigenetiske landskapet er forandret.
Eskelands forskningsgruppe jobber med epigenetiske mekanismer i spiserør-, prostata- og brystkreft. Gruppa er nå en del av CanCell, et av forskningsrådets nyeste sentre for fremragende forskning. Der skal de også studere sarkomer
Mange kreftsykdommer med felles opphav
Sarkomer er nokså sjeldne kreftsykdommer, og man vet lite om hvordan de utvikles. Felles for dem er cellenes opprinnelige opphav, det som i tidlig fosterutvikling kalles mesenkym. Sarkomer kan utvikles i knokler, muskler, bindevev, blod med mer.
Sarkomer rammer folk i alle aldre men noen former er mer dominerende i barn og unge. Overlevelsen er god, om lag 80 %, så lenge ikke kreften sprer seg. Med metastaser synker den raskt ned til om lag 16 %.
Dypdykk i sekvenser
NoSarC er et stort norsk samarbeid innen sarkomforskning, med en unik biobank på sarkomer. – Dette gir oss en gyllen mulighet til å studere epigenetiske endringer i denne kreftformen, forteller en begeistret Eskeland. NoSarC ledes av Ola Myklebost, og en av de andre gruppelederne i CanCell, Jørgen Wesche, leder sarkom gruppen på radiumhospitalet. Prosjektet har gjennom de siste årene sekvensert svulstprøver for å analysere hvilke mutasjoner disse kreftcellene har.
– Biobanken er en gullgruve for oss, fortsetter Eskeland, med så mye data. Vi samarbeider med informatikerne Sigve Nakken og Eivind Hovig i dette prosjektet, og skal ta et dypdykk i alle sekvenseringsdataene.
– Jeg er ingen kreftekspert, fortsetter hun. – Men epigenetikk det kan jeg! Sammen med forskeren Marie Rogne og et lite team skal vi studere dataene, gjøre epigenetiske analyser i sarkomer og prøve å forstå hvordan epigenetikken påvirker dannelsen og utviklingen av kreftceller.
Livet i sandkassa
Når Eskeland begynner å prate om dette går det entusiastisk unna.
– Noen sarkomer oppstår i barn og tenåringer, altså i ung levealder. Hvilke gener er feil uttrykt i disse krefttypene? Og er dette forskjellig fra de genene som blir feil uttrykt i sarkomer i voksne? Hvilken effekt har de på epigenetiske landskapet i disse cellene, undrer hun.
– Det blir gøy å klyve oppi sandkassa der alt ligger klart. Men der vi også kan forme mye nytt selv. Med store datasett tilgjengelig, er det mange nye spørsmål vi kan prøve å svare på og kombinere med de data vi opparbeider selv.
Epigenetiske feil
Eskeland vil starte med å studere liposarkomer, som er sarkomer i fettvev. Hun forteller at disse skiller seg fra for eksempel lungekreft.
I lungekreft har cellene ofte mange mutasjoner. De oppstår i stor grad etter miljøpåvirkninger, som for eksempel røyking, og de ligger spredt rundt på de forskjellige kromosomene i lungekreftcellene. Liposarkomer, derimot, har kun noen få mutasjoner, og de som er ligger samlet på noen få kromosomer. Disse mutasjonene har dessuten blitt kopiert opp, slik at cellene har flere kopier av hver av dem.
– Vi tror det er epigenetiske feil som ligger bak disse mønstrene, sier Eskeland. – Noe går feil når genene skal reguleres og vi ønsker å finne ut hva det er.
– Kanskje finner vi feil som kan behandles, håper hun – Det finnes allerede epigenetiske medikamenter som brukes i behandlingen av krefttyper som for eksempel leukemi. Kanskje noe tilsvarende vil kunne brukes mot sarkomer i fremtiden.
Omprogrammering fra farlig til snill
Dette arbeidet passer som hånd i hanske med CanCells ambisjoner om å omprogrammere kreftceller.
– Omprogrammering av celler er allerede et stort felt, men da ved at man endrer vanlige celler slik at de blir til stamceller, forteller Eskeland.
– I CanCell bruker vi samme tankegang, men på et annet bruksområde. Vi vil omprogrammere farlige kreftceller til å bli ufarlige varianter som man kan leve med. Epigenetiske justeringer er en viktig del av dette.
Epigenetikk på kromosomnivå
Vanligvis ikke en X
Eskelands iver er like stor når hun snakker om mekanismene bak epigenetiske endringer. Hva skjer med kromosomene når et gen skal bli aktivt, og hva skjer på DNA-nivå?
Hun forteller at de X’ene man ser for seg når man tenker på kromosomer ikke er representative for kromosomenes hverdag. De er kun tettpakkede X’er i forbindelse med celledeling, resten av tiden er de mer utflytende enn man tror. Og alle kromosomene har sin faste plass i cellekjernen.
Åpner kromosomet for aktive gener
Hvert eneste kromosom har mange gener som skrudd av og mange gener som er i bruk. For å få til dette må kromosomstrukturen pakkes opp, slik at genene blir tilgjengelige.
Kromosomer er derfor delvis pakket og delvis åpnet for aktivitet.
Løkker treffer løkker
I aktive områder i kromosomene ser man at DNA-tråden kommer ut i løkker. Disse løkkene møter en «fabrikk» med alt som trengs for at genene skal tas i bruk.
– Mange løkker ender dessuten i samme fabrikk, forteller Eskeland. – Gener fra forskjellige områder kan dermed interagere med hverandre.
– Ingenting i cellen er statisk. Selv genene beveger seg og samhandler med hverandre.
Filmer enkeltgener
Gruppen til Eskeland har fått støtte fra forskningsrådet til å utvikle egne teknikker for å studere dette. Vanligvis fikseres cellene fast på små glassplater og er døde når man ser på disse strukturene, men Eskeland vil studere dette ´live´ i mikroskopet. Altså, filme dynamikken i levende celler.
– For å få til dette samarbeider vi tett med forskere som kan mikroskopering av cellekjernen, sier Eskeland.
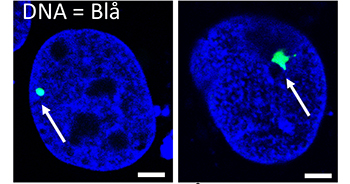
De har nå teknikker for å følge enkeltgener, og se på dem i tid og rom. De kan se når genene møter hverandre og de kan filme bevegelsene.

Alt DNA er farget blått. De to genene som samhandler er merket med grønne og røde fluoriserende proteiner (se piler). Legger man de tre første bildene oppå hverandre får man bildet til høyre. Foto: Beata Nadratowska-Wesolowska.
Eskeland forteller at de gleder seg til å jobbe med en ny enhet for mikroskopi som er under oppbygging på IMB. Det ledes av Hesso Farhan, og Eskeland forteller med iver om et høyhastighets konfokalmikroskop de vil få stor glede av.
Brenner for formidling
Snakker man med Eskeland er det ikke mye tvil om at hun brenner for forskning og epigenetikk, men hun er minst like opptatt av formidling og undervisning.
Det siste er litt komisk, forteller hun. – Far var lærer, og som ungdomsskoleelev var jeg helt klar på at det skulle jeg i hvert fall ikke bli. Aldri. Men her står jeg da... Og synes det er skikkelig gøy.
Hun holder jevnlig populærvitenskapelige foredrag og på twitter settes hele gruppa i sving. – Det er på twitter det skjer forteller hun. – Der går vi inn i diskusjoner og blir sett og hørt. Det skaper interesse for hva vi holder på med og kan bane vei for nye samarbeid og publikasjoner.
Eskeland har mye erfaring med formidling, noe hun tror også IMB vil ha nytte av.
Ung gruppe
Ragnhild Eskeland har bakgrunn fra Bergen, München, Edinburgh og nå sist Institutt for biovitenskap ved UiO.

– Jeg fikk en strålende anledning til å bygge opp min egen gruppe da jeg var uavhengig postdoc hos Odd Stokke Gabrielsen, forteller Eskeland. – Han forsker på transkripsjonsfaktorer og jeg på epigenetikk, og det har vært, og er fortsatt, et veldig nyttig samarbeid.
– Det har tatt tid å bygge opp helt egen forsking, metodikk, gruppe og nettverk, men nå begynner det å løsne. Eskeland sin gruppe har 5 mastergradsstudenter, 3 ph.d.-studenter, 2 postdoktorer og 2 forskere. Eskeland er gruppeleder i CanCell og endringmiljøet PharmaTox, begge på UiO.
Institutt for medisinske basalfag ønsker Ragnhild Eskeland velkommen.