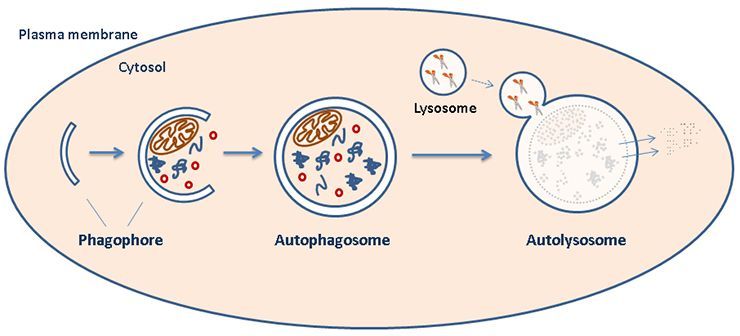
Kort historie om autofagiforskningen ved NCMM
Autofagi-teamet spant ut av et forskningsprosjekt initiert av Ian G. Mills, tidligere gruppeleder ved NCMM, og ble ledet av hans første postdoc, Nikolai Engedal.

Dr. Mills, som forsker på prostatakreft, studerte en kinase (CAMKK2, calmodulin-dependent kinase kinase 2) som viste seg å være en regulator av kreftmetabolismen. Dette styrte forskningen hans mot spesifikke gener og signalveier som så ut til å ha interessante implikasjoner som biomarkører eller terapeutiske mål for prostatakreft.
Litteratur og tidligere forskning antydet at CAMKK2 spilte en rolle både ved autofagi og i in vivo modeller av fedme. Ian Mills ansatte sin første postdoc, Nikolai Engedal, i 2010, og han hadde bakgrunn innen membrantrafikk, en grunnleggende prosess innen autofagi. Dette gjorde at videre studier av CAMKK2 i forbindelse med autofagi, ble naturlig.
Etter å ha studert prostata kreft, ble det tydelig at autofagi i seg selv, hvordan denne prosessen er regulert i kreft og hvordan den reagerer på ulike typer stress, var et forskningsområde som trengte mer oppmerksomhet. Teamet klarte å styrke sin posisjon takket være tildelingen av et Young Talent Grant fra Norges Forskningsrådet til Nikolai Engedal i 2014 samt rekrutteringen av Professor Per Seglen som Engedal hadde

startet et samarbeid med, som gjesteforsker ved NCMM. Teamet som ledes av Engedal, inkluderer også to stipendiater som snart har fullført sine doktorgrader og flere viktige vitenskapelige artikler har allerede blitt publisert.
Professor Per Seglens bidrag innen autofagi-forskning ble ytterligere anerkjent i 2017 da han ble tildelt Kong Olav Vs kreftforskningspris.
Team-leder Nikolai Engedal forteller om autofagi-teamets nåværende forskning ved NCMM
Autofagi-teamet vårt studerer prosesser som fører til intracellulær nedbrytning av cytoplasma, også kalt autofagi (gresk for selvfortæring).
Vi forsøker å forstå noen av de sentrale reguleringsmekanismene og mediatorene i denne prosessen og er særlig interessert i rollen autofagi spiller i aspekter relatert til kreft.
Hva jobber dere med for øyeblikket?
En av de viktigste bestrebelsene for øyeblikket er å avdekke hvordan forandringer i den intracellulære kalsiumbalansen og den såkalte «ufoldet protein responsen» (UPR) som utløses av stress i endoplasmatisk retikulum, regulerer autofagi. Intracellulær kalsiumforstyrrelse og UPR henger ofte sammen og begge er ofte sterkt involvert i kreft samt i andre sykdommer. Vi har oppdaget at kalsiumpumpe-inhibitorer som for eksempel planteforbindelsen thapsigargin, blokkerer autofagi fullstendig (Engedal et al., 2013, Autophagy 9(10):1475-90).
Vi følger nå opp disse funnene og forsøker å forstå sammenhengen mellom autofagi-prosessene, UPR og celledød under kalsiumforstyrrelser. I samarbeid med danske forskere ved DANDRITE (et av søstersentrene i det nordiske EMBL-partnerskapet) undersøker vi nå funksjonen til thapsigargin-analoger som utgjør de aktive ingrediensene i mulige terapeutiske kreft-legemidler som for øyeblikket testes i kliniske studier på kreftpasienter. I en annen del av prosjektet studerer vi andre faktorer som induserer UPR, men som ikke fremprovoserer like sterke kalsiumforstyrrelsene som thapsigargin og som aktiverer autofagi.
Vi har allerede funnet ut hvilken UPR-signalvei som kontrollerer autofagi, og vi forsøker nå å identifisere spesifikke nedstrøms-mediatorer av UPR-indusert autofagi. I to helt forskjellige prosjekter studerer vi i tillegg flere grunnleggende aspekter i autofagi-prosessen. Vi analyserer i første omgang rollen til de humane motstykkene til det basale autofagi-maskineriet i gjær (identifisert av fjorårets Nobelprisvinner Dr. Ohsumi med flere) under sult og stress-indusert autofagi i humane celler. I tillegg undersøker vi en ny type autofagi med andre egenskaper og som er regulert annerledes enn noen form for autofagi beskrevet til nå.
Hva håper dere å oppdage?
Vi håper vår forskning kan bidra med grunnleggende informasjon som er nødvendig for å få et fullt bilde av autofagi-prosessene i humane celler. Autofagi er mye mer komplekst i humane celler enn i en encellet organisme som for eksempel gjær, og flere av de humane ortologene til aktørene i autofagi-maskineriet i gjær ser ut til å spille forskjellige og mer varierte roller i humane celler. Teamet vårt har et unikt fokus på å analysere funksjonene i generell autofagi, og vi håper å oppdage nøkkel-mediatorer og regulatoriske mekanismer knyttet til denne prosessen. Videre ønsker vi å forstå fellestrekk og ulikheter mellom den generelle prosessen og andre mer spesialiserte former for autofagi som for eksempel eksklusiv degraderingen av spesifikke cellulære mål.
Når det gjelder kalsium og UPR, håper vi å forstå hvordan de ulike cellulære signalene er integrert og blir translatert til enten autofagi eller celledød responser.
Videre håper vi å fastslå nøyaktig hvordan og ved hvilke trinn de trer inn i autofagi-prosessen. Dette vil gi oss kunnskap som er viktig for fremtidige terapeutiske strategier og utvikling av nye legemidler for å behandle kreft og andre sykdommer.
Hvor tror du ditt forskningsfelt vil være om ti år og hvordan ser fremtiden ut for autofagi-forskningen ved NCMM?
Autofagi er et av de raskest voksende feltene i cellebiologi. Autofagi-prosesser ser ut til å spille en sentral rolle i normal human fysiologi så vel som i aldring og en stadig voksende liste av sykdommer. Så langt finnes det kun svært få, ganske uspesifikke kliniske legemidler som er rettet mot autofagi. Derfor legger både akademia og farmasøytiske selskaper i dag stor vekt på å utvikle og produsere nye og mer spesifikke legemidler rettet mot autofagi-mål som kan brukes til å behandle humane sykdommer.
Dette må selvsagt gå hånd i hånd med grunnleggende forskning om autofagi-mekanismer og signalveier fordi dette er den eneste måten spesifikke og effektive legemidler kan utvikles på. Om ti år tror jeg vi vil se enda mer aktivitet på dette spennende, men fremdeles unge forskningsfeltet. Forhåpentligvis vil vi da også ha sett andre-generasjons autofagi-rettede legemidler komme i bruk.
NCMM som et nasjonalt senter for molekylærmedisin og translasjonsforskning, har potensial til å være en viktig aktør til å kunne akselerere denne utviklingen.